Технология умягчения воды с помощью электромагнитного поля применяется на практике уже более 20-ти лет. За это время она доказала свою эффективность и с успехом используется как в промышленной теплоэнергетике, так и для коммерческих и частных нужд.
Тем не менее, существует множество противников данного метода, отрицающих или ставящих под сомнение саму возможность такого метода умягчения воды.
К сожалению, это мнение нередко можно встретить и в серьёзных публикациях, в большинстве случаев без предоставления научных или любых других доказательств неэффективности данного метода умягчения воды. На различных сайтах, форумах также встречаются жалобы на отсутствие эффективности электромагнитных умягчителей воды.
Нам известно, что существуют компании, производящие аналоги умягчителей воды Рапресол, которые не создают желаемого эффекта. Оставим это на совести таких недобросовестных производителей.
Отметим лишь, что электромагнитные умягчители воды Рапресол:
- Защищены Патентом РФ и зарегистрированным Торговым Знаком и имеют всю необходимую разрешительную документацию : сертификат соответствия Госстандарта РФ, санитарно-эпидемиологическое заключение.
- Оформлена Декларация о соответствии требованиям технического регламента Таможенного союза (декларация ТР ТС) ТС № RU Д-RU.АД83.B.04362.
- Компания НПП «АНН» получила сертификат соответствия системе менеджмента качества ISO 9001:2008 при производстве приборов Рапресол.
- Эффективность электромагнитных умягчителей воды Рапресол подтверждена результатами независимого экспертного заключения, основанного на объективных данных инструментального контроля за работой теплообменника производства «Ридан» модель НН-07, установленного в системе ГВС.
- Об эффективности работы приборов свидетельствуют также многочисленные отзывы эксплуатирующих организаций, от Калининграда до Владивостока
Мы попытаемся максимально доступно описать принцип электромагнитного умягчения воды, основываясь на нашем собственном более чем 10-ти летнем опыте производства и успешного применения безреагентных электромагнитных умягчителей воды Рапресол.
Немного о терминах.
Нам часто задают вопрос: «Почему Вы используете термин «умягчение воды» и называете ваш прибор «умягчителем воды»?»
В традиционном понимании «умягчение воды» — это снижение концентрации солей жесткости и приведение этих показателей к рекомендованным значениям.
Эффект от воздействия наших приборов на процесс предотвращения образования накипи схож с умягчение воды в традиционном понимании, однако концентрация солей кальция и магния при обработке не меняется, общая жесткость воды также не изменяется (о принципе работы приборов мы расскажем далее). Поэтому название «умягчители воды» используется в достаточной степени условно.
Процесс образования накипи
В большинстве случаев появление накипи связано с присутствием в воде солей кальция и магния в виде гидрокарбонатов.
Кальций Ca — это мягкий белый металл, в чистом виде он в природе не встречается, потому что на воздухе он вступает в реакцию с кислородом.
Реакция взаимодействия кальция с кислородом описывается химическим уравнением:
2Ca + O2 → 2CaO
Цифра 2 перед формулой вещества означает, что в реакции участвуют 2 молекулы.
Из кальция и кислорода получается оксид кальция. Это вещество тоже не встречается в природе потому что он вступает в реакцию с водой:
CaO + H2O → Ca(OH2)
Получается гидроксид кальция. Из формулы видно, что гидроксид образован одним атомом кальция и двумя гидроксильными группами.
Но и гидроксид кальция не встречается в природе из-за постоянного присутствия в воздухе углекислого газа. Он довольно хорошо растворяется в воде, образуя угольную кислоту:
CO2 + H2O ⇌ H2CO3
Знак ⇌ говорит о том, что реакция может проходить в обе стороны при одинаковых условиях.
Далее гидроксид кальция, растворённый в воде, вступает в реакцию с угольной кислотой и превращается в малорастворимый карбонат кальция:
Ca(OH)2 + H2CO3 → CaCO3↓ + 2H2O
Стрелка вниз означает, что в результате реакции вещество выпадает в осадок.
При дальнейшем контакте карбоната кальция с углекислым газом в присутствии воды происходит обратимая реакция образования кислой соли — гидрокарбоната кальция, который хорошо растворим в воде
CaCO3 + CO2 + H2O ⇌ Ca(HCO3)2
Реакция обратима, процесс может происходить в обоих направлениях. Так, при увеличении температуры бикарбонат кальция распадается на карбонат кальция CaCO3 (часто его известью), углекислый газ и воду.
Какая из этих двух реакций имеет место — зависит от баланса «известь- углекислота». Если присутствует избыток CO2 — известь растворяется, в противном случае – формируется. Эти процессы также зависят от изменений давления, температуры и других физических параметров.
Именно карбонат кальция, практически всегда содержащийся в воде природных источников, образует кристаллические осадки на теплообменных поверхностях котлов, бойлеров, трубопроводов.
Процесс кристаллизации извести
Известь может кристаллизироваться в форме двух различных структур, полностью идентичных по химическому составу.
В процессе кристаллизации может образовываться кристаллическая решётка типа арагонита (рис.1) и решётка типа кальцита (рис. 2). Кристаллическая решётка будет зависеть от термодинамических условий и других факторов (давление, температура, напряженность электрического, магнитного поля и т.д.), в которых происходила модификация.
Под воздействием электромагнитного поля содержащиеся в воде магниевые и кальциевые соли теряют способность формироваться в виде плотного отложения.
Вместо карбоната кальция в форме кальцита образуется более щадящая мелкокристаллическая полиморфная форма СаСО3 , по структуре напоминающая арагонит, который или совсем не выделяется из воды, поскольку рост кристаллов останавливается на стадии микрокристаллов, или выделяется в виде тонкодисперсной взвеси, скапливающейся в грязевиках или отстойниках
Кристаллическая решётка типа кальцита также характерна для карбоната магния и карбоната железа (MgCO3 и FeCO3), и именно поэтому эти вещества также встроены в образования накипи. Кроме того, ангидрит (сухой гипс) или гипс ([CaSО4 х 2H2O]) также имеют кристаллические решётки типа кальцит. В подобного типа решётку кристаллизуются и сульфаты, фосфаты, силикаты кальция и магния. Поэтому они также включаются в состав накипных отложений.
Накипь в трубопроводах
Если внимательно посмотреть на участки труб, где откладывается карбонат кальция, становится понятно, почему он выпадает в осадок из своего растворённого состояния.
Первоначально пятна известковых отложений наблюдаются:
- на изгибах и на разветвлениях труб
- на точках водопотребления (кранах, душевых насадках)
- и особенно в местах, где течёт горячая вода.
В последнем случае важно различать: ёмкости для горячей воды, в общем- то, свободные от отложений, и нагревающие панели, нагревающие спирали и теплообменные поверхности (поверхности, передающие тепло воде), которые всегда покрыты слоем отложений.
Почему именно пятна? Ответ прост: в некоторых местах присутствует градиент энергии, который приводит к искажению гидратных оболочек вокруг растворённых ионов солей Ca и Mg так, что те могут реагировать друг с другом.
В то же самое время должен быть нарушен баланс «известь-углекислота», и это означает, что должна наблюдаться локальная нехватка углекислого газа CO2.
В этом случае ионы карбоната кальция ищут центры кристаллизации, где начинается процесс кристаллизации.
Пятна извести всегда располагаются на стенках труб, которые представляют собой твёрдую основу, на которой могут расти кристаллы. Далее ионы прибывают всё больше и больше, отложения растут и образуют плотную корку, называемую накипью.
Накипь образована рядом ионов и состоит из карбоната кальция, смешанного с магнием; в её состав также входят гипс, силикаты, железо (поэтому цвет накипи часто жёлто-коричневый).
Эти отложения ускоряют коррозию и ухудшают передачу высокой температуры от нагревательных панелей и теплообменников.
Откуда появляются локальные градиенты энергии в воде?
В случае нагревательных панелей — в этих местах воде передаётся высокая температура.
В местах изгиба труб :
вода, текущая по внешнему радиусу изгиба трубы, двигается быстрее, чем вода на внутреннем радиусе. Согласно упрощённому уравнению Бернулли, сумма статического и динамического давления – постоянная величина. Pдин + Pстат = константа.
В воде, которая течет быстрее, динамическое давление увеличивается, а статическое давление уменьшается. Это означает, что CO2 перемещается от внутреннего радиуса к внешнему радиусу, и баланс «известь-углекислота» нарушается.
Известь высвобождается, ищет центр кристаллизации и находит этот центр на стенах внутреннего радиуса трубы. Постепенно слой извести на стенках трубы нарастает, в него привносятся также и другие минералы.
На этих шершавых поверхностях развиваются процессы турбулентности. Этот же процесс из-за колебаний давления происходит в разветвлениях трубы, так, чтобы в обоих случаях развиваются отложения извести.
Поскольку вода и CO2 испаряются в кранах и насадках для душа, то в этих местах также растут отложения извести.
Если посмотреть на заросшие накипью трубы – мы увидим, что корка накипи изначально всегда образуется в местах сгиба или на ответвлениях, и уже оттуда переходит на прямые участки труб.
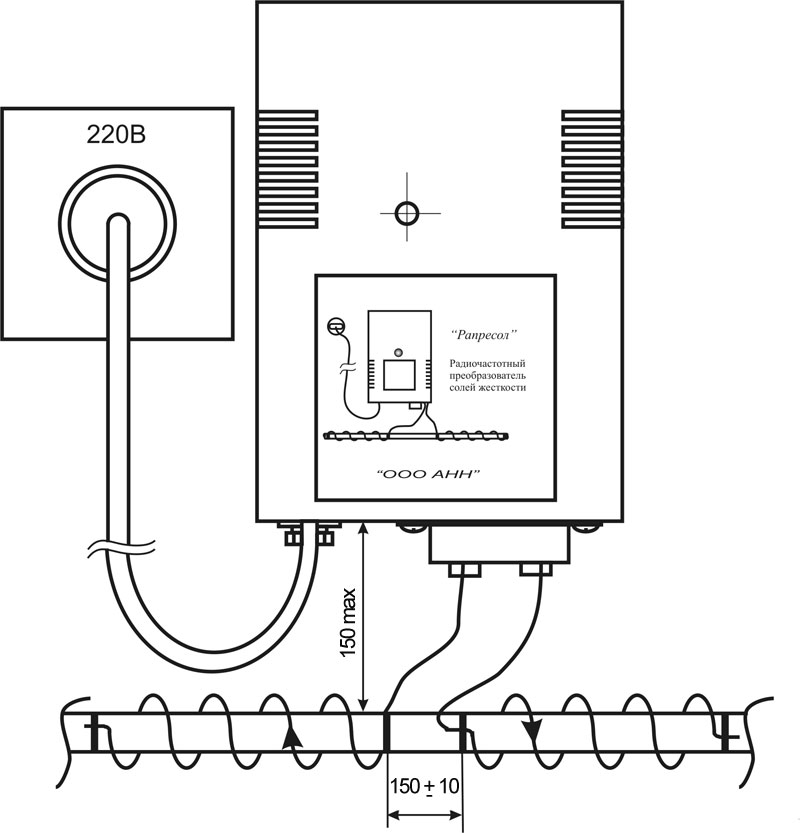
Принцип работы электромагнитного умягчителя воды Рапресол
Умягчитель воды Рапресол представляет собой пластиковый корпус, с тыльной стороны которого имеется отверстие для крепления к стене. На лицевой стороне имеется светодиодный сигнализатор работы прибора. В нижней части расположен предохранитель и выходят шнур питания и провода излучатели (2 или больше). Внутри корпуса расположена печатная плата с электронными компонентами.
В качестве источника электромагнитного поля используется генератор несинусоидальных электромагнитных колебаний качающейся частоты, к противофазным выходам которого подключены провода-излучатели, навиваемые во взаимно противоположных направлениях на магистральный трубопровод.
Генератор формирует плавно изменяющиеся колебания в диапазоне частот от 1 кГц до 10 кГц, то есть часть диапазонов инфранизких частот (0,3–3 кГц) и очень низких частот (3–30 кГц).
При работе прибора частота колебаний непрерывно и плавно изменяется от минимума до максимума и обратно.
Электромагнитное поле попадает внутрь трубопровода, вне зависимости от его материала, следующим образом:
На провода-излучатели подают противофазные импульсы напряжения с частотой, формируемой генератором несинусоидальных колебаний качающейся частоты.
Благодаря емкостной связи между проводами-излучателями и магистральным трубопроводом (в случае токопроводящего трубопровода), или с водой в магистральном трубопроводе (в случае не токопроводящего трубопровода), на участке магистрального трубопровода, между навитыми во взаимно противоположном направлении проводами-излучателями возникают знакопеременные импульсы тока, порождающие знакопеременное магнитное поле, как вне так и внутри магистрального трубопровода, которое в свою очередь порождает в проводящей жидкости, в воде, знакопеременные импульсы тока и т.д.
Таким образом, в потоке воды, прокачиваемой по магистральному трубопроводу, создается импульсное знакопеременное электромагнитное поле с постоянно меняющейся во времени частотой.
Эффект воздействия переменного электромагнитного поля сопровождается поляризацией растворённых в воде ионов и деформацией их гидратных оболочек, приводящих к уменьшению гидратации.
Гидратация является важным фактором, обуславливающим растворимость солей в воде, электролитическую диссоциацию, распределение веществ между фазами, кинетику и равновесие химических реакций в водных растворах, в свою очередь повышающих вероятность сближения гидратов ионов и процессы седиментации и кристаллизации неорганических солей.
Растворённая в воде известь – гидрокарбонат кальция – диссоциирует в дважды положительно заряженный ион кальция и два отрицательно заряженных иона гидрокарбоната. Эти ионы окружены гидратной оболочкой.
Молекулы воды обосновываются вокруг иона кальция так, чтобы кислород с частично отрицательным зарядом был ближе к положительно заряженному иону кальция, и водород с частичным отрицательным зарядом был направлен наружу. Электростатические силы связывают эти кластеры вместе. Ион гидрокарбоната окружён точно так же, но атомы кислорода молекул воды направлены наружу. Эти кластеры в целом проявляют положительный или, соответственно, отрицательный заряд
Если частота электромагнитных колебаний является подходящей, то гидратные оболочки вокруг ионов распадаются, что также приводит к локальному уменьшению концентрации СО2.
Чтобы вызвать эти процессы, электрическое переменное поле должно содержать частоты, по возможности, приводящие к резонансным колебаниям гидратных оболочек.
Электрические колебания распространяются параллельно направлению трубы. Физически – это акустическая продольная ударная волна.
При этом сменяются области со сверхдавлением и очень низким давлением. На уровне атомных и молекулярных полей это вызывает локальное растворение СО2.
Баланс «известь- углекислота» локально нарушен, и в это время растворённые ионы извести, освобождённые от гидратных оболочек, могут встречаться и реагировать друг с другом: образуется молекула извести, которая теперь служит центром кристаллизации.
В дальнейшем другие молекулы извести концентрируются вокруг центра кристаллизации и образуют в воде кристалл извести. Этот кристалл извести электрически нейтрален и больше не вступает в реакцию с другими примесями в воде. Поэтому такие кристаллы больше не образуют отложений извести на стенках трубы.
Ускорение процесса кристаллизации накипеобразующих солей в воде при электромагнитной обработке, приводит к значительному уменьшению концентраций растворенных в воде катионов Ca2+ и Mg2+ за счет процесса кристаллизации и уменьшения размеров кристаллов, осаждающихся из нагреваемой воды, подвергнутой обработке.
Сформировавшиеся кристаллы извести вымываются из трубы с водой, их кристаллизация на стенакх трубы более невозможна.
Удаление сформировавшейся ранее накипи
Уравнение превращение растворённого гидрокарбоната кальция в нерастворимый карбонат кальция и углекислый газ и наоборот:
Ca(HCO3)2 ⇌ CaCO3 + CO2 + H2O
Здесь играет важную роль баланс «известь — углекислый газ». Если есть излишек CO2 — он взаимодействует с водой, образуя угольную кислоту:
Ca (HCO3)2 ↔ CaCO3↓ + H2CO3.
Нестойкая угольная кислота электролитически диссоциирует. Она также склонна к образованию углекислого газа
CO2 + H2O ↔ H2CO3 ↔ H+ +HCO3-
Угольная кислота разрушает старые известковые осадки в трубах, водонагревателях и др. Она постепенно воздействует на отложения на стенах трубы и растворяет их, то есть удаляет уже сформировавшуюся накипь.
В зависимости от уровня инкрустаций в трубе (жёсткая вода, срок службы), этот процесс может длиться от 1-2 месяцев до двух лет.
Избыток угольной кислоты смещает равновесие реакции влево, то есть приводит к повторному образованию бикарбоната кальция.
На практике это означает, что в обработанной воде через несколько суток вновь образуется бикарбонат кальция (вода «теряет» свои свойства после электромагнитного воздействия).